Physiopathologie de la polyarthrite rhumatoïde: acquisitions récentes
- Détails
- Mis à jour le 22 août 2016
L. Achemlal A. Nouijai M. Ghazi A. Mounach A. Bezza A. El Maghraoui.
Centre de Rhumatologie et Rééducation fonctionnelle Hôpital Militaire Mohammed V Rabat Maroc
La polyarthrite rhumatoïde (PR) est le rhumatisme le plus fréquent. Sa fréquence est estimée à 1% de la population adulte. Récemment la prise en charge thérapeutique connaît un élan considérable grâce à une meilleure connaissance de son immunopathogénie. La PR est une maladie d'étiologie inconnue multifactorielle avec intrication de facteurs psychologiques (facteur déclenchant) hormonaux (sexe féminin périménopause) environnementaux (germes tabac) et génétiques (terrain HLA DR4 dans 60% des cas et DR1 dans 30% des cas).
Schématiquement la PR est due à un ou des antigènes inconnus qui sont présentés au lymphocyte T par une cellule présentatrice d'Antigène grâce aux molécules d'histocompatibilité HLA classe II. Le lymphocyte T en général de type T4 (mémoire) devient ainsi actif et sera à l'origine de certaines réactions (12):
Ø sécrétion de cytokines : par action directe ou par l'intermédiaire d'autres cellules.
Ø activation des synoviocytes et des fibroblastes avec constitution du pannus.
Ø stimulation du lymphocyte B qui va se transformer en plasmocyte avec sécrétion du facteur rhumatoïde et d'autres immunoglobulines comme les anti CCP.
Présentation d'antigène
Elle se fait grâce à des cellules présentatrices d'antigène (CPA). Actuellement c'est la cellule dendritique qui suscite le plus d'intérêt car en plus de son rôle de CPA elle joue un rôle majeur dans l'immunité en intégrant les signaux entre les cellules présentes dans la synoviale. Elle peut de ce fait faire l'objet d'une thérapeutique ciblée (3).
Reconnaissance de l'antigène.
Elle se fait essentiellement par les lymphocytes TCD4 pour les exo-Ag. Après que ces derniers ont été intégrés par les molécules HLA de classe II. Ceci est rendu possible par la parenté entre l'Ag et la 3ème région hypervariable de cette molécule et notamment les séquences d'acides aminés situés entre la position 72 et 74 (Epitope partagé). Ce concept est élargi récemment à la position 70 et 71. La modulation du risque est maximale en fonction de l'acide aminé qui est en 70 (maximale si lysine moyenne si arginine faible si alanine ou acide glutamique) (45).
La présence des TCD8 en grand nombre dans la synoviale suscite beaucoup d'intérêt. En fait ces cellules sont à l'origine de la reconnaissance d'endoantigènes et explique en partie l'échec du traitement ciblant les TCD4 (Fig.1).
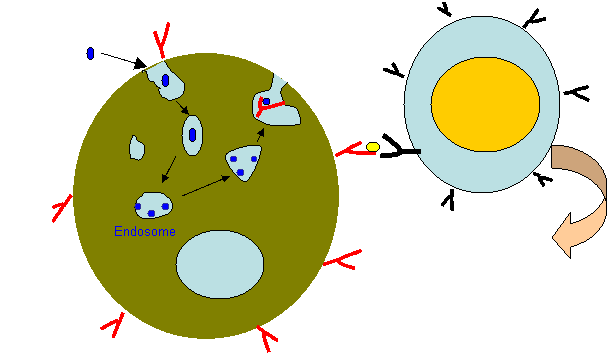
Figure 1 : Présentation et reconnaissance de l’antigène.
Activation du lymphocyte T.
Initialement naïf le lymphocyte T activé est de type mémoire il va être à l'origine de plusieurs phénomènes. L'activation du lymphocyte T est de mieux en mieux connue grâce aux voies de co-stimulation (Fig.2) dont les principales entre le CD20 et son ligand CD80-CD86. Actuellement la découverte d'une nouvelle molécule la CTLA-4 dont le rôle est de bloquer cette co-stimulation a ouvert une nouvelle voie thérapeutique. Le produit (Abatacept) est commercialisé sous le nom d'Orencia et les résultats sont excellents.
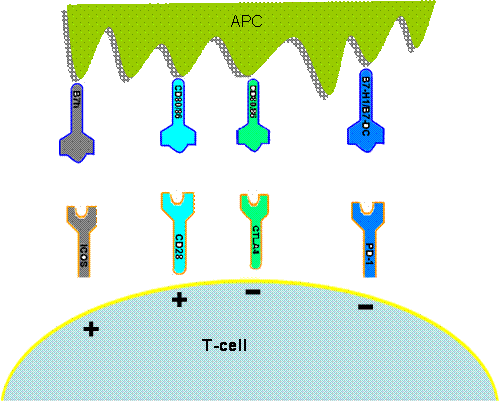
Figure 2 : voies de co-stimulation entre la cellule présentatrice d’antigène (APC) et le lymphocyte T
Le lymphocyte T activé va alors orchestrer certaines réactions :
1- sécrétion de cytokines soit directement ou par l'intérmidiaire d'autres cellules (les macrophages par exemple).
Dans la PR il existe un déséquilibre entre les cytokines pro-inflammatoires dont les principales sont le TNFα IL1 IL6 et les cytokines anti-inflammatoires (Fig. 3). Le but des traitements ciblés est de rétablir l'équilibre en inhibant les cytokines pro-inflammatoires ou en apportant les anti-inflammatoires (8). L'action des cytokines est complexe. Elles agissent par un mode autocrine paracrine ou endocrine. Leur action s'étale à plusieurs niveaux que nous verrons ultérieurement.

Figure 3 : rupture de l’équilibre en faveur des cytokines pro-inflammatoires.
2- activation du lymphocyte B.
Actuellement le langage entre LT et LB est mieux connu et se fait par l'intermédiaire du système BLYs ou BAFF dont le blocage constitue une nouvelle voie thérapeutique (Fig.4). Les essais thérapeutiques à base d'anticorps ou de récepteur soluble de BLys ont donné de bons résultats.
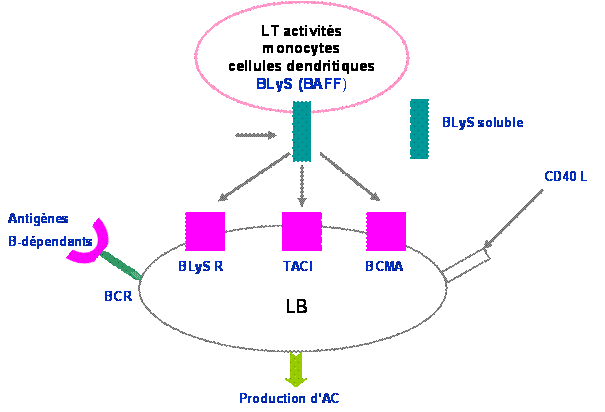
Figure 4 : activation du lymphocyte B par le système BLys.
Une fois le lymphocyte B activé il devient l'instigateur de plusieurs effets (9) :
a- la production de cytokines pro-inflammatoires.
b- La présentation d'antigènes au lymphocyte T avec le maintient de son activation.
c- Il se transforme en plasmocyte avec production d'immunoglobulines : facteur rhumatoïde (FR) et anticorps antipeptides citrullinés (anti CCP) par exemple. Ces immunoglobulines peuvent maintenir un rétrocontrôle avec maintien de la stimulation du LB ; d'où leur intérêt aussi bien diagnostique que pronostique.
Le lymphocyte B joue un rôle majeur dans la physiopathologie de la PR et dans le maintien des phénomènes inflammatoires. De ce fait il constitue une cible thérapeutique notamment par les anticorps anti CD20 (rituximab) dont l'efficacité est actuellemnt démontrée.
3-activation des synoviocytes et des fibroblastes
La PR est considérée comme une maladie systémique au départ avec localisation articulaire. En effet la synoviale est peu ou pas vascularisée. Dans la PR elle se trouve inondée de cellules inflammatoires qui ont migré à travers l'endothélium c'est le phénomène d'angiogenèse. Ceci est rendu possible grâce aux cellules d'adhésion (ICAM, VCAM .....) aux cytokines pro-angiogéniques et certains facteurs de croissance (VGEF, CMSF.....)(10). Actuellement l'inhibition ou le blocage de certaines de ces molécules empêche la migration et la périnisation de la synovite nous prenons pour exemple l'inhibition du VGEF par un anticorps spécifique qui empêche l'apparition de l'arthrite (11-13).
En plus de l'angiogenèse le pannus synovial résulte aussi d'une prolifération importante et non freinable des synoviocytes par anomalie de l'apoptose qui est définie par la mort cellulaire programmée. Le pannus constitue une véritable tumeur qui continue à proliférer. L'apoptose joue un rôle primordial dans l'immunopathogénie de la PR. Les principaux éléments de sa régulation sont le système Fas- Fas ligand et surtout la protéine p53. Celle-ci existe dans chaque cellule. Elle est considérée comme gardien du génome et chaque fois qu'elle détecte une anomalie elle ordonne le décès de la cellule. Les souris Knock Out (dépourvues de la p53 développent des arthrites destructrices) (14).
Erosions et destruction articulaire
Elles constituent l'étape terminale du mécanisme physiopathologique de la PR. L'activation des synoviocytes par le lymphocyte T ou par les cytokines inflammatoires va libérer certaines enzymes les métalloproteiases Celles-ci vont entraîner la dégradation du cartilage la mise à nue puis la destruction de l'os sous chondral.
Actuellement l'ostéolyse est mieux expliquée par le système Rank/Rank Ligand/Ostéprotégérine dont l'inhibition empêche l'apparition des érosions mais ne prévient pas l'inflammation (Fig.5). Ceci s'explique en pratique par la dissociation qu'on voit dans certaines PR très inflammatoires sans être érosives ou l'inverse (15-18).
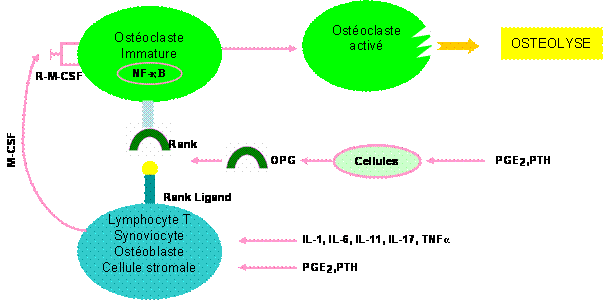
Figure 5 : rôle du système Rank Rank ligand Ostéoprotégérine dans l’ostéolyse.
Conclusion
Les connaissances physiopathologiques de la PR ont fait l’objet récemment d’énormes progrès. Elles ont ouvert la voie à l’ère des biothérapies et des drogues dites ciblées. Certes des inconnus persistent mais le visage et la prise en charge de la PR ont nettement changé.
J. Sany. Pathogénie et immunopathologie de la polyarthrite rhumatoïde. La lettre du rhumatologue – Hors série – avril 1999:10-6.
F.Wolf T. Pincus. Rheumatoid arthritis. Pathogenesis assessment outcome and treatment. Eds.New York: Marcel Dekker 1994 1 volume 521.
AA. Manfredi MG. Sabbadini P. Rovere-Querini. Dendritic cells and the shdow line between autoimmunity and disease. Arthritis Rheum.2005; 52(1) : 11-5.
J. Roudier N. Balandraud B. Mugnier S. Guis D. Reviron C. Roudier I. Auger. Rôles des molécules HLA-DR dans le développement de la PR. Rev. Du Rhum. 2005 ; 72: 287-89.
ST. du Montcel L. Michou E. Petit-teixeira et al. New classification of HLA-DRB1 alleles supports the shared epitope hypothesis of rheumatoid arthritis susceptibility. Arthritis Rheum.2005; 52(4):1063-8.
G. Falgarone O. Jaen M-C Boissier M. Breban. Dialogue entre les lymphocytes et les cellules dendritiques au cours de l'inflammation rhumatoïde. Rev.du Rhum. 2005 ; 72 : 297-302.
C. Fournier. Que reste- t –il du lymphocyte T dans la polyarthrite rhumatoïde? Rev. Du Rhum. 2005 ; 72 :290-6.
J. Sany. La polyarthrite rhumatoïde de l'adulte. Eds. John Libbey Eurotext Paris 1999 1volume 283p.
G.J Silverman and D. A Carson. Roles of B cells in rheumatoid arthritis. Arthritis Res. Ther. 2003 5(suppl 4) (DOI 10.1186/ar1010).
J. Roudier. Evénements initiaux dans la PR. Rev.du Rhum. 2004; 71:10s-14s.
M.A. Gougerot-Pocidalo L. Halbwatchs-Mecarelli. L'activation du polynucléaire neutrophile dans la synovite rhumatoïde.Rev. du Rhum. 2005 ; 72 : 303-9.
AE. Koch. Angiogenesis as a target in rheumatoid arthritis. Ann. Rheum.Dis 2003; 62: 60-67.
P. Brenchley. Antagonising angiogenesis in rheumatoid arthritis. Ann.Rheum.Dis. 2001 60: iii71-iii74.
SL.Teitelbaum FP.Ross. Genetic regulation of osteoclast development and function. Nat Rev Genet 2003; 4: 638-49.
U.Feige. Ostoprotegerin. Ann.Rheum.Dis. 2001 60: iii81-iii84.
A.R Petit J. Hong D.Von Stechow R. Mueller. et al. Trance/Rank knockout mice are protected from bone erosion in the k/BxN serum transfer model of arthritis. Arthritis Rheum.2001 44(suppl.): s326 abstract.
E. Romas N.A Sims D.Hards M. Lindsay et al. Fc- osteoprptegerin fusion proteine (Fc-OPG) reduces osteoclast numbers and prevents bone destruction in rats with collagen- induced arthritis. Arthritis Rheum.2001 44(suppl):s267 abstract.
X. Mariette D. Wendling. Polyarthrite rhumatoïde. La lettre du rhumatologue n 278-janvier 2002 : 7-16.
Articles les plus lus
- L'arthrose cervicale
- L'arthrose lombaire
- La spondylarthrite ankylosante
- Coxarthrose
- La fibromyalgie
- Les anti-inflammatoires non stéroïdiens. Modalités de prescription.
- Apport de l’échographie dans le diagnostic d’une épaule douloureuse.
- La gonarthrose
- La maladie de Behçet
- Diagnostic précoce de la polyarthrite rhumatoïde



